题目内容:
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫。在催化剂作用下,CO2和H2可以制取甲醇和乙醇。如:2CO2(g)+6H2(g)
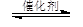 CH3CH2OH(g)+3H2O(g) 。
CH3CH2OH(g)+3H2O(g) 。(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表。分析表中数据回答下列问题:
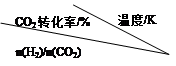
500
600
700
800
1.5
45
33
20
12
2.0
60
43
28
15
3.0
83
62
37
22
温度升高,平衡常数K值将(填“增大”、“减小”、或“不变”)。提高氢碳比[n(H2)/n(CO2)], 平衡常数K值将(填“增大”、“减小”、或“不变”)。
在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积B.通入CO2C.升高温度到800K D.使用合适的催化剂
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
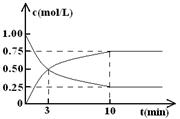
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=;
氢气的平衡浓度为mol/L。
参考答案:
